UDI – Unique Device Identifier to system do
Unikalnej Identyfikacji Wyrobów Medycznych. Do tej pory obowiązek
znakowania wyrobów medycznych zgodny z wymogami prawnymi i koncepcją UDI
obowiązywał w eksporcie na rynek amerykański. Jednak od 2021 roku
Komisja Europejska wymóg ten wprowadzi również na terenie całej Unii
Europejskiej.
Obowiązek znakowania UDI będzie szczególnie
istotny dla producentów, którzy zajmują się identyfikacją na każdym
etapie tworzenia danego modelu wyrobu tj. projektowania, produkowania,
zaopatrywania, użytkowania, konserwacji i usuwania.

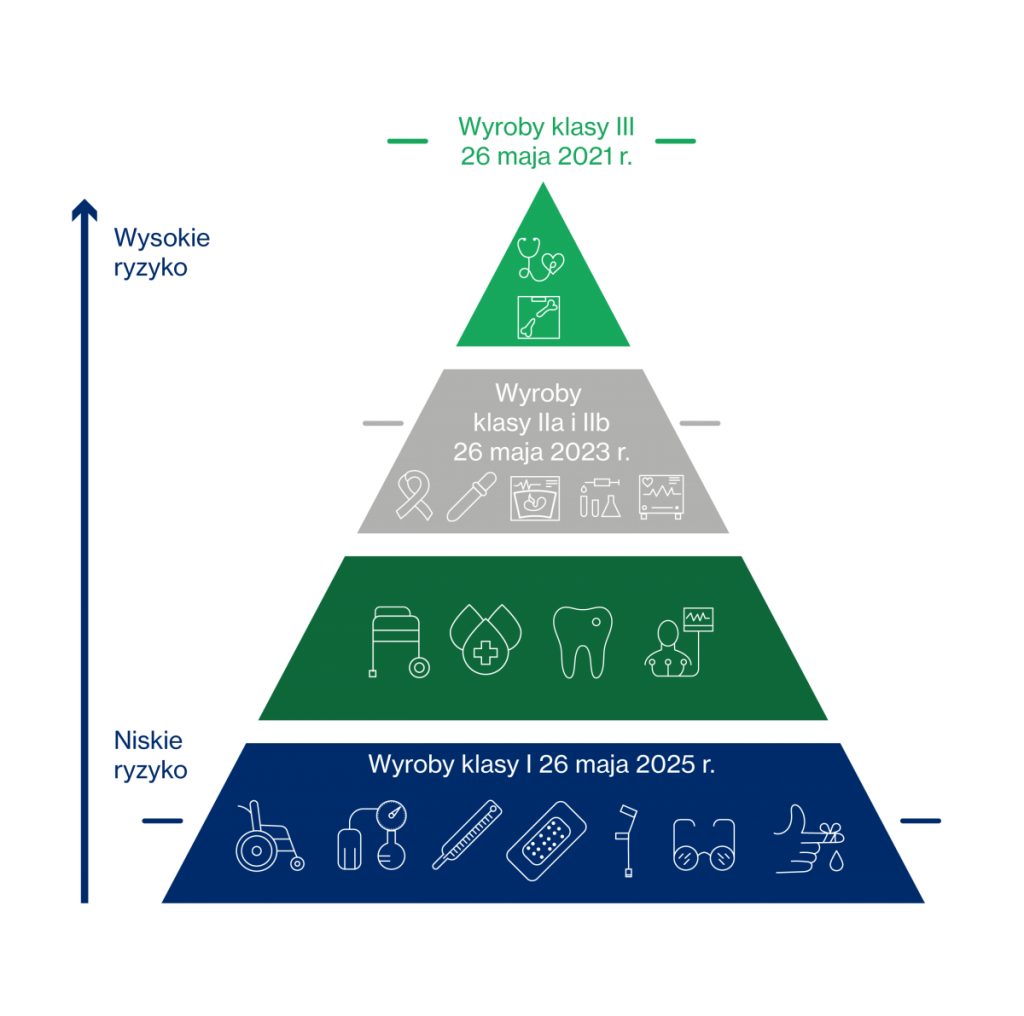
Co więcej będzie dotyczył wszystkich klas wyrobów medycznych: I, IIa, IIb oraz III. Warto tutaj przypomnieć, że klasyfikacja ta jest oparta o kryterium narażenia ciała ludzkiego (uwzględnia potencjalne ryzyko związane z projektem technicznym i produkcją wspomnianych wyrobów). Stąd zasada znakowania UDI w tym przypadku jest prosta: im wyższa jest klasa wyrobu, tym bardziej restrykcyjna jest procedura oceny zgodności. Od klasy danego wyrobu zależeć będzie także kiedy obowiązek UDI zostanie wprowadzony. W przypadku wyrobów najwyższego ryzyka, czyli tych zaliczanych do klasy III zacznie obowiązywać od 26 maja 2021 roku. Dla wyrobów klasy IIa i IIb będzie to data 26 maja 2023 roku. Z kolei dla wyrobów klasy I – termin: 26 maja 2025 roku.
Decyzją
Komisji Europejskiej akredytację do nadawana identyfikatorów UDI
posiada neutralna organizacja non-profit – GS1, która już od 2013 roku
zajmuje się nadawaniem identyfikatorów UDI w Stanach Zjednoczonych.
Wdrożenie UDI składać się będzie z trzech kroków:
Co umożliwi takie wdrożenie?
Uzyskane
dane pozwolą ograniczyć wybrane błędy medyczne, a co za tym idzie
skutecznie monitorować i eliminować działania niepożądane. Dodatkowo UDI
usprawni efektywność pracy na magazynie i punktach opieki zdrowotnej,
ale również wpłynie na zwiększenie bezpieczeństwa pacjentów,
podniesienie jakości opieki zdrowotnej oraz usprawnienie procesów
biznesowych z zakresu szeroko pojętej ochrony zdrowia.